美国是世界上最大的细胞治疗研发国家,在INFORMA药物数据库注册的374项基因与细胞治疗(CGT)临床试验,美国以120项临床试验遥遥领先[1]。 在干细胞治疗研究领域,全球出现“一超多强”的格局。相比美国,我国的细胞治疗研究起步并不算早,但发展速度较快。在细胞治疗监管领域,美国已经形成了一套成熟且完备的制度体系。
美国细胞治疗监管体系概述
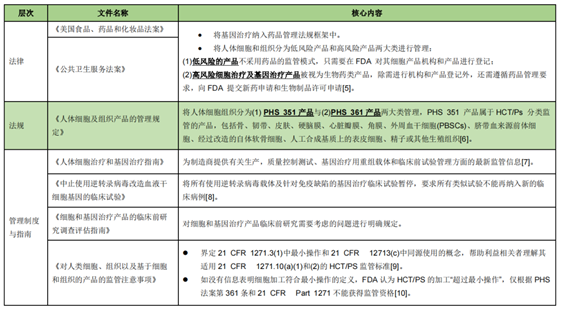
美国将细胞治疗归为生物制品范畴,由美国FDA的生物制品评估研究中心(CBER)统一负责审批监管,细胞治疗监管体系由上位法律、法规、管理制度与指南三部分构成,将细胞治疗按照风险大小进行评估制定不同规范来调整。
合规监管要点和合规建议
外资限制合规监管要点和合规建议
美国一直将生物技术、基因治疗作为国家的关键技术领域。在出口、外资准入方面采取了一系列管制措施防止技术外流,保持其在生物技术领域的国际领先地位。美国商务部(BIS)在《Commerce Control List》(美国商业管制清单,“CCL”)中对生物技术领域进行了出口管制,其中具体的管制类别包括:1C351人类和动物病原体、毒素;1C353 遗传元素和转基因生物;1C991疫苗、免疫毒素、医疗产品等。美国工业安全局在2021年12月6日补编:1C991“免疫毒素”是指与毒素结合的单克隆抗体,其目的是破坏特定的靶细胞,而不影响邻近细胞[12],即细胞治疗。
美国对细胞治疗进行不同级别的出口管制,在2018年的《The Foreign Investment Risk Review Modernization Act of 2018》(2018外国投资风险评估现代化法案,“FIRRMA”)中规定,美国外国投资委员会(CFIUS)将对外国投资者主要进行以保护国家安全为目的的审查,考虑要素的第1条就是“是否该国投资的目标是获取核心技术”,第5 条是“是否可能暴露公民信息、基因信息给外国政府或外国自然人”[13] 。因此,对于想要投资细胞治疗领域的外国投资者,无论是采取并购还是投资等方式,不排除面临CFIUS的相应审查。
细胞治疗临床研究合规监管要点及合规建议
美国FDA将临床研究分为新药临床试验(investigational new drug,IND)和非注册临床试验(non-IND)。具体的监管规定如下:

美国将IIT分为三类,其中:实验用药为上市后说明书内使用的研究按照Non-IND-IIT进行管理、实验用药为上市后说明书以外使用的研究,新药研究按照IND-IIT进行管理。特别地,实验用药为上市后说明书以外使用的研究在满足一定条件下可豁免IND申报,豁免条件为:(1)试验不为申请新适应症提供支援或为药品说明书的重大改动提供依据;(2)试验不为处方药广告中重大改动提供支援;(3)试验不涉及给药途径、剂量、受试人群或者其他显著增加用药风险的因素;(4)试验操作符合21 CFR 50 和56 部分关于机构审查委员会和知情同意的条款;(5)试验按照 § 312.7 规定 (研究性新药的推广与收费) 执行。细胞治疗企业在美开展相应试验时需关注对应研究类型和范围,以进行相应的IND申报工作。
细胞治疗企业运营资质合规监管要点及合规建议
在研发环节,1976年11月美国FDA颁布了GLP法规草案,1979年正式实施,要求无论是项目认证还是实验室认证都要符合GLP要求[15] ;
在注册环节,美国的《质量协定指南》规定MAH对产品上市放行及生产或委托的控制或物料的质量负最终责任[16];在生产环节,美国的GMP由《联邦食品、药品和化妆品管理法》(FDCA)及《美国联邦法规》第200-299部分进行了规定,GMP认证程序分为上市前检查、常规监督检查及有因检查,FDA对在GMP检查中严重违规的将会公布警告信,对于未能及时答覆的或充分纠正的,依据风险采取停止药品批准注册、发出进口禁令等制裁措施[17] 。
人类遗传资源跨境传输合规监管要点及合规建议
美国人类遗传资源的管理主体主要由以下几个机构构成[19]:
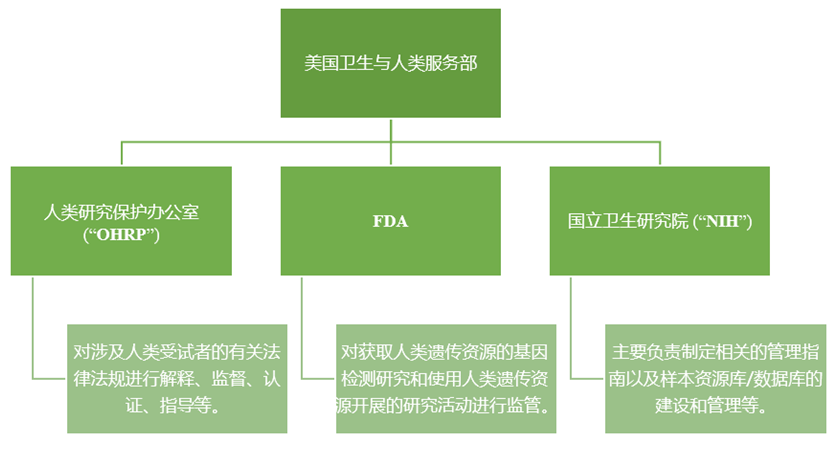
其中,NIH于2003、2007、2014年分别发布及修订了基因组资料共享政策 (GDS) ,要求所有向NIH申请项目经费在50万美元以上的科研人员必须提交一份资料共享计划或资料保密说明,并按规定共享科学资料。在资料共享中涉及到的受试者隐私保护方面,美国还出台了相关的法律,如《健康保险携带和责任法》(HIPAA)、《反基因歧视法》等,其中HIPPA 明确提出了受保护的健康信息去识别的标准;反基因歧视法提出了知情同意原则、维护个人遗传机密性等人类遗传资源管理和保护的原则[20] 。
根据美国健康与人类服务部体受试者保护规定及健康保险隐私及责 任法案中的隐私规则,向NIH指定资料存储库提交的人类基因组资料要进行去识别处理,并取得数据库的保密证书作为附加预防措施,防止任何可辨识个人身份的信息遭强制披露[21] ,否则面临相应处罚。
细胞治疗企业的上市审核合规监管要点及合规建议
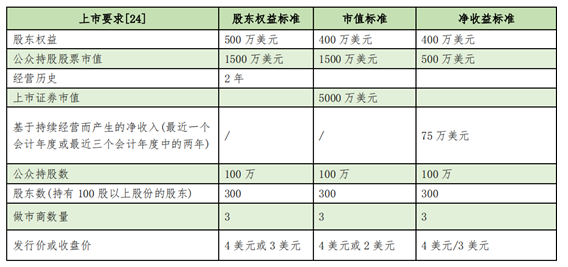
在美国《纳斯达克上市标准》中,对细胞治疗等生物医药企业并没有提出具有达到1期或2期核心产品的要求,只对市值、净收益等制定了明确标准。
-美国监管体系完善和合规问题探讨
综合全文,可以发现美国监管体系有两点优势:一是通过细胞治疗风险等级进行分级分类规范,实现精准监管;二是国家监管主体明确,且各监管主体之间的权责分明。
国家相关监管体系将日趋规范化、全面化和细致化,对于我国细胞治疗企业机构来说,在具有研发实力的基础上,完善实验室及临床试验质量监控,遵守注册/备案及GMP和GCP相关要求也是细胞治疗企业机构必须做好的一环。
